400-998-5282
专注多肽 服务科研
400-998-5282
专注多肽 服务科研
来源于单纯疱疹病毒 (HSV) 糖蛋白 B 的免疫显性表位,对应其 498-505 残基序列,可作为 H-2Kb 限制性和 HSV-1/2 交叉反应性细胞毒性 T 淋巴细胞 (CTL) 识别表位。
编号:200622
CAS号:149997-91-1
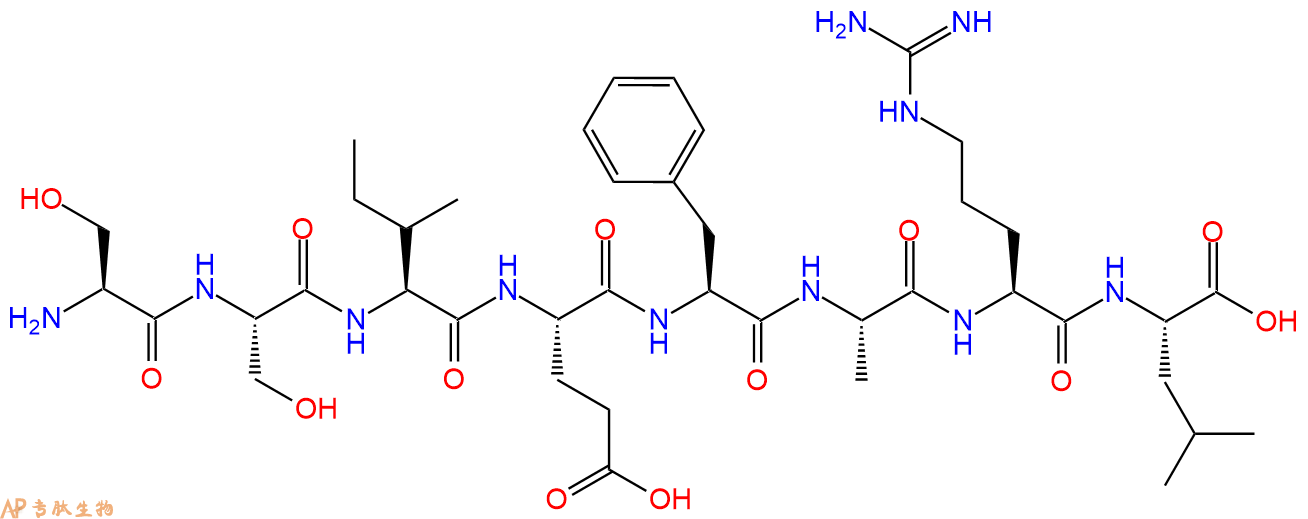
单字母:H2N-SSIEFARL-OH
HSV-gB2 (498-505) 是来源于单纯疱疹病毒 (HSV) 糖蛋白 B 的免疫显性表位,对应其 498-505 残基序列,可作为 H-2Kb 限制性和 HSV-1/2 交叉反应性细胞毒性 T 淋巴细胞 (CTL) 识别表位。
HSV-gB2 (498-505) is an immunodominant epitope from herpes simplex virus (HSV) glycoprotein B residues 498-505, acts as H-2Kb-restricted and HSV-1/2-cross-reactive cytotoxic T-lymphocyte (CTL) recognition epitope.
背景
糖蛋白B(485-492)的化学式为C41H67N11O13,氨基酸序列为H2N-Ser-Ser-Ile-Glu-Phe-Ala-Arg-Leu-OH,分子量为922.04。糖蛋白B是一种病毒糖蛋白,参与单纯疱疹病毒(HSV)进入细胞的过程。疱疹病毒含有一个包被和一个外脂质双层,其中包含12个表面糖蛋白。单纯疱疹病毒包被与细胞膜融合,经过内吞作用,双链DNA基因组进入宿主细胞,产生感染(1)。疱疹病毒糖蛋白B是所有细胞膜糖蛋白中最高度保守的,主要作为融合蛋白。gB和gH/ gL的精确功能未知,但它们对于病毒进入细胞是必须的,构成核心融合单位。糖蛋白B的胞质域内的某些突变引起显著的合胞体表型(2),且与其它病毒融合蛋白具有结构同源性,由此认为gB参与了融合过程(3)。
参考文献:
1. PereiraL, Ali M, Kousoulas K, Huo B, Banks T (September 1989). "Domain structure of herpes simplex virus 1 glycoprotein B: neutralizing epitopes map in regions of continuous and discontinuous residues". Virology 172 (1): 11–24.
2. Bender FC, Samanta M, Heldwein EE, de Leon MP, Bilman E, Lou H, Whitbeck JC, Eisenberg RJ, Cohen GH (April 2007). "Antigenic and mutational analyses of herpes simplex virus glycoprotein B reveal four functional regions". J. Virol. 81 (8): 3827–41.
3. Heldwein EE, Lou H, Bender FC, Cohen GH, Eisenberg RJ, Harrison SC (July 2006). "Crystalstructure of glycoprotein B from herpes simplex virus 1". Science 313 (5784): 217–20.
定义
几种病毒肽是 细胞毒性T淋巴细胞 (CTL)表位或H-2Db限制性表位,有助于 T细胞受体识别过程,并在那里 清除被 病毒感染的细胞。
Discovery
Tsomides TJ等人在1994年建立了一种基于稳定稳定地表达从HIV血清阳性个体获得的HIV-1和CTL的新开发细胞系的检测系统。他们鉴定了MHC-1分子内源性呈递的HIV肽1。可以通过酸洗脱从感染了病毒的细胞中提取此类肽。来自流感病毒核蛋白的天然加工的H–2–Db限制肽和H–2–Kd限制肽均小于相应的合成肽,后者首先用于确定各自的CTL表位。与次要的组织相容性抗原一样,病毒肽的出现似乎严重依赖于MHC I类分子,因为被感染的H-2d细胞不含H-2-Db限制性肽,而被感染的H-2b细胞也不包含HHC-2类。 H-2-Kd限制肽。数据为上述概念提供了直接的实验证据,证明了病毒感染细胞2上与MHC相关的病毒肽的概念。
结构特征
小鼠MHC I类分子(H-2Kb)的X射线结构与两种不同的病毒肽(来自水泡性口炎病毒核蛋白VSV-8和仙台病毒核蛋白SEV-9)复合测定。H-2Kb络合物的VSV-8精制为2.3,SEV-9精制为2.5。H-2Kb的结构与人类HLA I类具有高度相似性,尽管各个结构域的排列可能略有变化。两种肽都以延伸的构象结合,其大部分表面掩埋在H-2Kb结合槽中。纳米单体肽主要通过在其他β构象的中心插入凸起来维持与八聚体相同的氨基和羧基末端相互作用。大多数特异性相互作用是在H-2Kb的侧链原子和肽的主链原子之间。该结合方案在很大程度上解释了以高亲和力结合I类分子的肽序列的巨大多样性。H-2Kb的微小但显着的构象变化与肽结合有关,这些协同运动可能是T细胞受体识别过程不可或缺的一部分3。
行动方式
通过破坏受病毒感染的细胞,受MHC限制的CTL在针对多种病毒的免疫反应中起着核心作用。与抗体不同,CD8 + CTL除了识别来自病毒编码的细胞表面糖蛋白的序列外,还识别来自细胞内病毒蛋白的保守序列。几种病毒表达的基因会下调I类MHC蛋白的表达,从而为它们提供了逃避细胞毒性T淋巴细胞的手段,但使它们易于被NK细胞裂解。I类MHC分子几乎无处不在的表达提供了一种手段,NK细胞可通过这些手段在可能丢失或下调的表面I类MHC分子的修饰靶细胞之间进行区分。I类MHC蛋白的缺失或失调可能部分解释了NK细胞如何调查组织中I类MHC的正常表达,缺失的自我假设。肿瘤细胞下调I类MHC蛋白的表达,而表达I类蛋白的肿瘤细胞则比特异性缺乏I类MHC表达的衍生物更能抵抗NK细胞的杀伤。可以通过转染适当的I类MHC分子来拯救对NK裂解敏感的I类阴性突变细胞系 4,5。
功能
消除病毒感染的细胞,可以通过CTL消除病毒感染的细胞,CTL可以识别与细胞表面2的MHC I类分子结合的病毒衍生肽。
天然杀伤(NK)细胞 被I型主要组织相容性复合物配体的特定同型异型抑制,该配体被多态性抑制受体(例如NKIR1和NKIR2)识别。NK1和NK2特异性克隆识别两组HLA-C同种异型,这些同种异型的特征是在α1螺旋中的残基80(分别为αLys-80和αAsn-80)处具有双态性。谷氨酸脱羧酶或柯萨奇病毒(每种都与自身免疫性糖尿病有关)衍生的肽废除了这种抑制性识别6。
感染后1-2周内会出现针对多种HIV产品(例如gag,pol,nef,env)的CD8 + CTL,这些CTL的异常高频率提示了它们的重要性:通常可以在新鲜分离的中检测到它们没有体外抗原刺激的PBMC通常需要证明其在其他病毒感染中的CTL活性 1。
参考
1、Tsomides TJ, Aldovini A, Johnson RP, Walker BD, Young RA, Eisen HN (1994). Naturally processed viral peptides recognized by cytotoxic T lymphocytes on cells chronically infected by human immunodeficiency virus type 1. J Exp Med., 180(4):1283-1293.
2、Rötzschke O, Falk K, Deres K, Schild H, Norda M, Metzger J, Jung G, Rammensee HG (1990). Isolation and analysis of naturally processed viral peptides as recognized by cytotoxic T cells. Nature, 348(6298):252-254.
3、Fremont DH, Matsumura M, Stura EA, Peterson PA, Wilson IA (1992). Crystal structures of two viral peptides in complex with murine MHC class I H-2Kb. Science, 257(5072):919-927.
4、Ljunggren H-G, Karre K (1990). In search of the 'missing self': MHC molecules and NK cell recognition. Immunol Today., 11(7):237-244.
5、Kärre K, Ljunggren HG, Piontek G, Kiessling R. (1986). Selective rejection of H-2-deficient lymphoma variants suggests alternative immune defence strategy. Nature, 319:675–678.
6、Mandelboim O, Wilson SB, Valés-Gómez M, Reyburn HT, Strominger JL (1997). Self and viral peptides can initiate lysis by autologous natural killer cells. PNAS., 94(9):4604-4609.
| DOI | 名称 | |
|---|---|---|
| 10.1006/viro.1993.1346 | Epitope specificity of H-2Kb-restricted, HSV-1-, and HSV-2-cross-reactive cytotoxic T lymphocyte clones | 下载 |
多肽H2N-Ser-Ser-Ile-Glu-Phe-Ala-Arg-Leu-COOH的合成步骤:
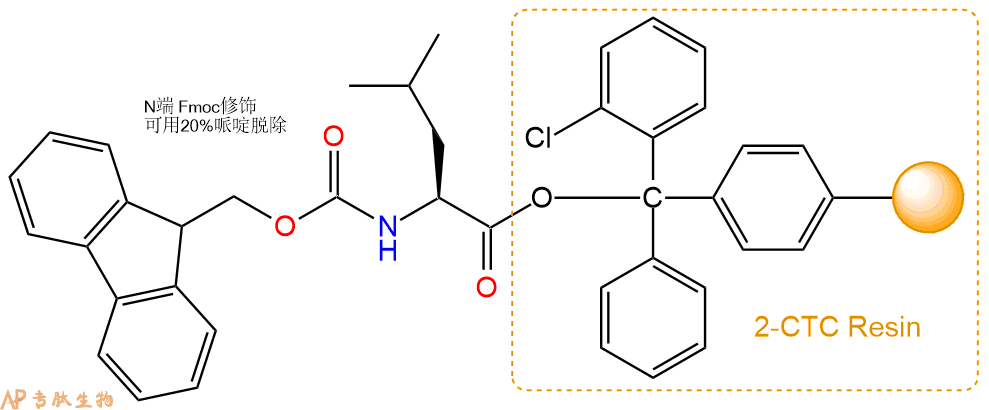
1、合成CTC树脂:称取2.96g CTC Resin(如初始取代度约为1.14mmol/g)和4.05mmol Fmoc-Leu-OH于反应器中,加入适量DCM溶解氨基酸(需要注意,此时CTC树脂体积会增大好几倍,避免DCM溶液过少),再加入10.12mmol DIPEA(Mw:129.1,d:0.740g/ml),反应2-3小时后,可不抽滤溶液,直接加入1ml的HPLC级甲醇,封端半小时。依次用DMF洗涤2次,甲醇洗涤1次,DCM洗涤一次,甲醇洗涤一次,DCM洗涤一次,DMF洗涤2次(这里使用甲醇和DCM交替洗涤,是为了更好地去除其他溶质,有利于后续反应)。得到 Fmoc-Leu-CTC Resin。结构图如下:
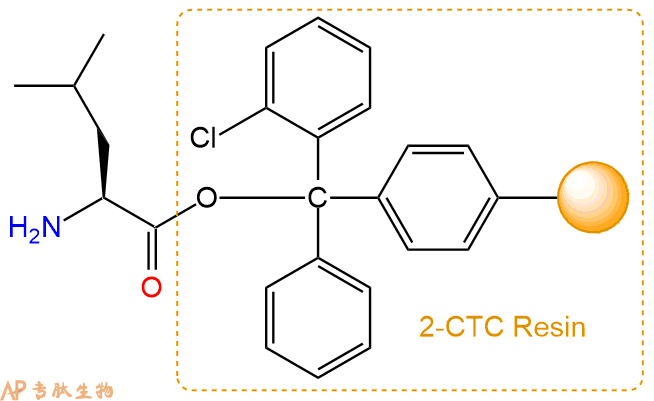
2、脱Fmoc:加3倍树脂体积的20%Pip/DMF溶液,鼓氮气30分钟,然后2倍树脂体积的DMF 洗涤5次。得到 H2N-Leu-CTC Resin 。(此步骤脱除Fmoc基团,茚三酮检测为蓝色,Pip为哌啶)。结构图如下:
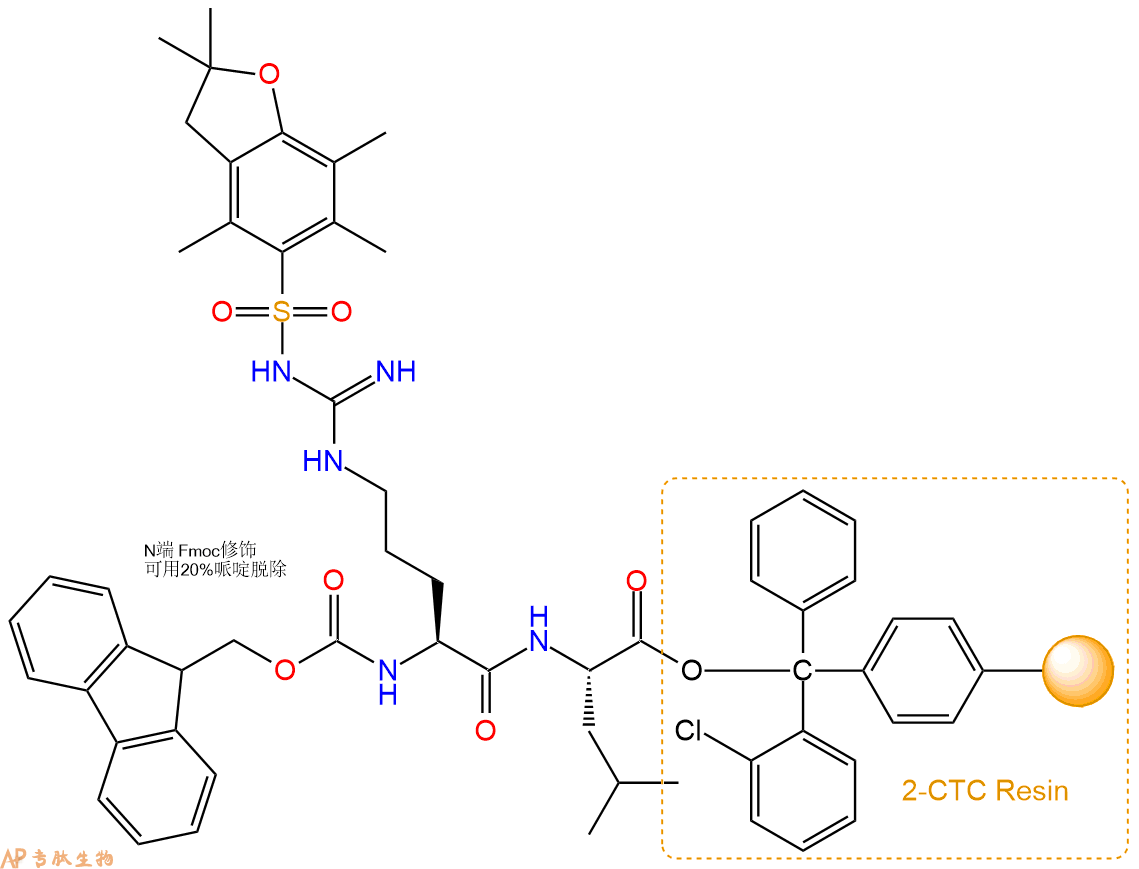
3、缩合:取10.12mmol Fmoc-Arg(Pbf)-OH 氨基酸,加入到上述树脂里,加适当DMF溶解氨基酸,再依次加入20.25mmol DIPEA,9.62mmol HBTU。反应30分钟后,取小样洗涤,茚三酮检测为无色。用2倍树脂体积的DMF 洗涤3次树脂。(洗涤树脂,去掉残留溶剂,为下一步反应做准备)。得到Fmoc-Arg(Pbf)-Leu-CTC Resin。氨基酸:DIPEA:HBTU:树脂=3:6:2.85:1(摩尔比)。结构图如下:
4、依次循环步骤二、步骤三,依次得到
H2N-Arg(Pbf)-Leu-CTC Resin
Fmoc-Ala-Arg(Pbf)-Leu-CTC Resin
H2N-Ala-Arg(Pbf)-Leu-CTC Resin
Fmoc-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
H2N-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
Fmoc-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
H2N-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
Fmoc-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
H2N-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
Fmoc-Ser(tBu)-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
H2N-Ser(tBu)-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
Fmoc-Ser(tBu)-Ser(tBu)-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin
以上中间结构,均可在专肽生物多肽计算器-多肽结构计算器中,一键画出。
最后再经过步骤二得到 H2N-Ser(tBu)-Ser(tBu)-Ile-Glu(OtBu)-Phe-Ala-Arg(Pbf)-Leu-CTC Resin,结构如下:
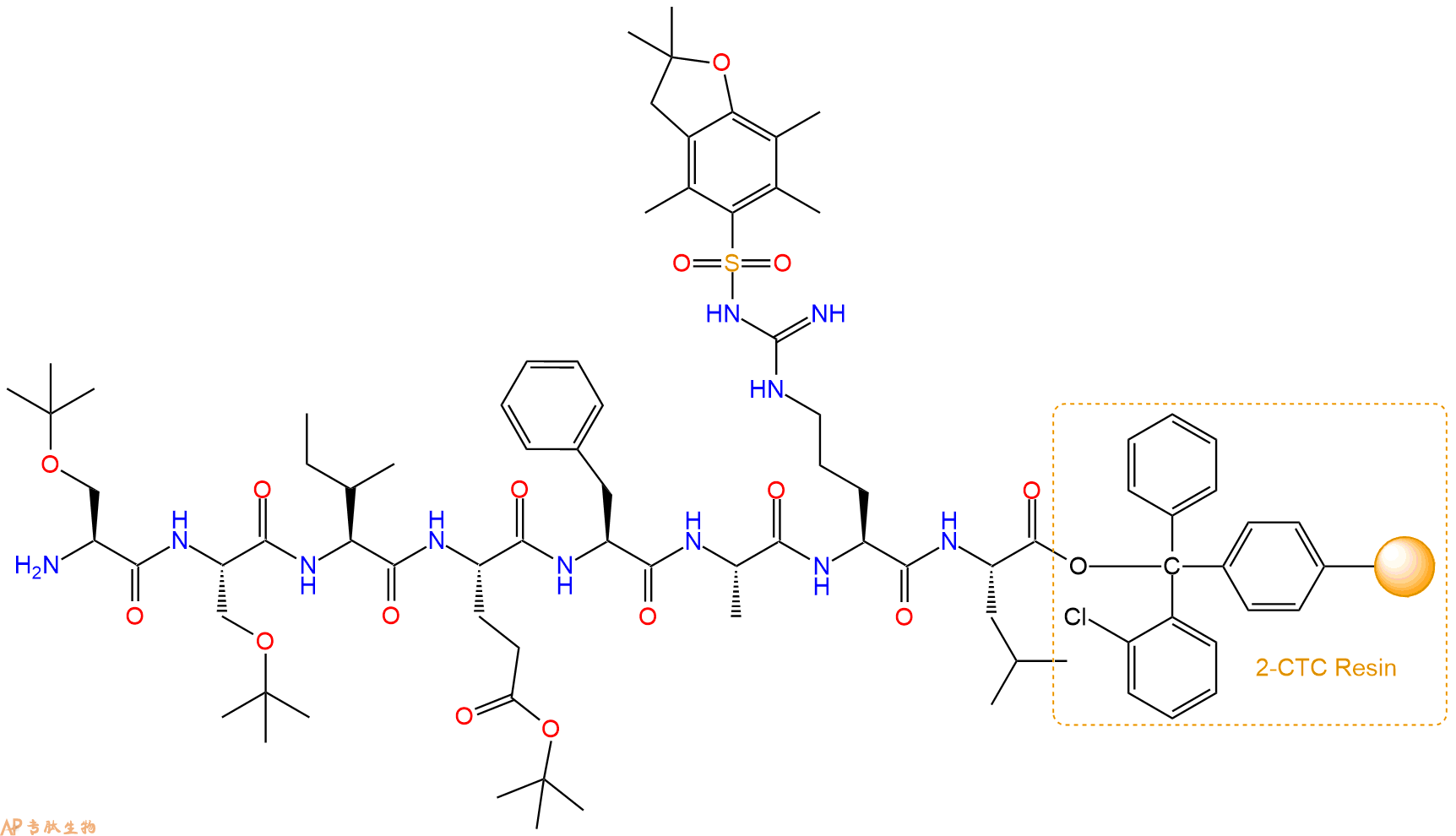
5、切割:6倍树脂体积的切割液(或每1g树脂加8ml左右的切割液),摇床摇晃 2小时,过滤掉树脂,用冰无水乙醚沉淀滤液,并用冰无水乙醚洗涤沉淀物3次,最后将沉淀物放真空干燥釜中,常温干燥24小试,得到粗品H2N-Ser-Ser-Ile-Glu-Phe-Ala-Arg-Leu-COOH。结构图见产品结构图。
切割液选择:1)TFA:H2O=95%:5%、TFA:H2O=97.5%:2.5%
2)TFA:H2O:TIS=95%:2.5%:2.5%
3)三氟乙酸:茴香硫醚:1,2-乙二硫醇:苯酚:水=87.5%:5%:2.5%:2.5%:2.5%
(前两种适合没有容易氧化的氨基酸,例如Trp、Cys、Met。第三种适合几乎所有的序列。)
6、纯化冻干:使用液相色谱纯化,收集目标峰液体,进行冻干,获得蓬松的粉末状固体多肽。不过这时要取小样复测下纯度 是否目标纯度。
7、最后总结:
杭州专肽生物技术有限公司(ALLPEPTIDE https://www.allpeptide.com)主营定制多肽合成业务,提供各类长肽,短肽,环肽,提供各类修饰肽,如:荧光标记修饰(CY3、CY5、CY5.5、CY7、FAM、FITC、Rhodamine B、TAMRA等),功能基团修饰肽(叠氮、炔基、DBCO、DOTA、NOTA等),同位素标记肽(N15、C13),订书肽(Stapled Peptide),脂肪酸修饰肽(Pal、Myr、Ste),磷酸化修饰肽(P-Ser、P-Thr、P-Tyr),环肽(酰胺键环肽、一对或者多对二硫键环),生物素标记肽,PEG修饰肽,甲基化修饰肽
以上所有内容,为专肽生物原创内容,请勿发布到其他网站上。





